Le 31 Janvier 2024, La Fondation Droit Animal, Éthique et Sciences (LFDA) a honoré le Dr Alexandra Benchoua du prix de biologie Alfred Kastler 2023, qui encourage l’utilisation de méthodes non-animales dans la recherche. Elle a été récompensée pour ses travaux sur les cellules souches pluripotentes induites (iPSC), qui permettent le remplacement d’animaux en expérimentation pré-clinique. Le FC3R a eu le privilège d’échanger avec la lauréate pour en découvrir plus sur son projet et les perspectives qu’il offre.
Alexandra Benchoua est directrice de recherche au sein de l’Institut des cellules Souches pour le Traitement et l'Étude des maladies Monogéniques (I-STEM) au Genopole. Son laboratoire utilise des cellules souches humaines pluripotentes pour la modélisation de maladies génétiques rares, dont les troubles neurodéveloppementaux du spectre autistique (maladie de Lesch-Nyhan, syndrome de Phelan-McDermid). Elle est aussi responsable de la plateforme Stem-CARE, constituée de 6 plateaux technologiques qui proposent des services tels que la bioproduction, le criblage ou le séquençage à haut débit.

Du rongeur aux cellules souches humaines, son parcours dans la neuroscience
Après une thèse sur les accidents vasculaires cérébraux (AVC) réalisée sur modèle murin au CHU Henri Mondor, le Dr Benchoua rejoint le CEA d’Orsay pour un post-doc sur la maladie d’Huntington. C’est en développant des cultures primaires de neurones de rats, que le Dr Benchoua s’est trouvée confrontée à des défis de répétabilité et de reproductibilité, liés à l’hétérogénéité des sources de cellules. Ces difficultés ont été décisives pour le choix du Dr Benchoua en faveur des méthodes non-animales.
C’est ainsi qu’elle part en 2005 à Édimbourg travailler dans un laboratoire pionnier dans le développement de cellules souches embryonnaires (CSE) pluripotentes humaines où elle se consacre à l’étude des signaux qui orientent le développement des CSE vers la différentiation en neurones. En 2006, le Dr Yamanaka (lauréat du prix Nobel de Physiologie et de médecine en 2012) révolutionne le domaine des cellules souches pluripotentes en découvrant la méthode de reprogrammation de cellules adultes via des facteurs de transcriptions (Takahashi et al., 2006 ; Takahashi et al., 2007). Il devient donc possible pour les chercheurs de travailler sur des cellules souches pluripotentes humaines sans avoir recours à des embryons. A son retour en France, le Dr Benchoua monte son équipe de recherche au sein de l’I-STEM, où elle travaillera avec cette méthode.
Du prélèvement sanguin au criblage de molécules thérapeutiques
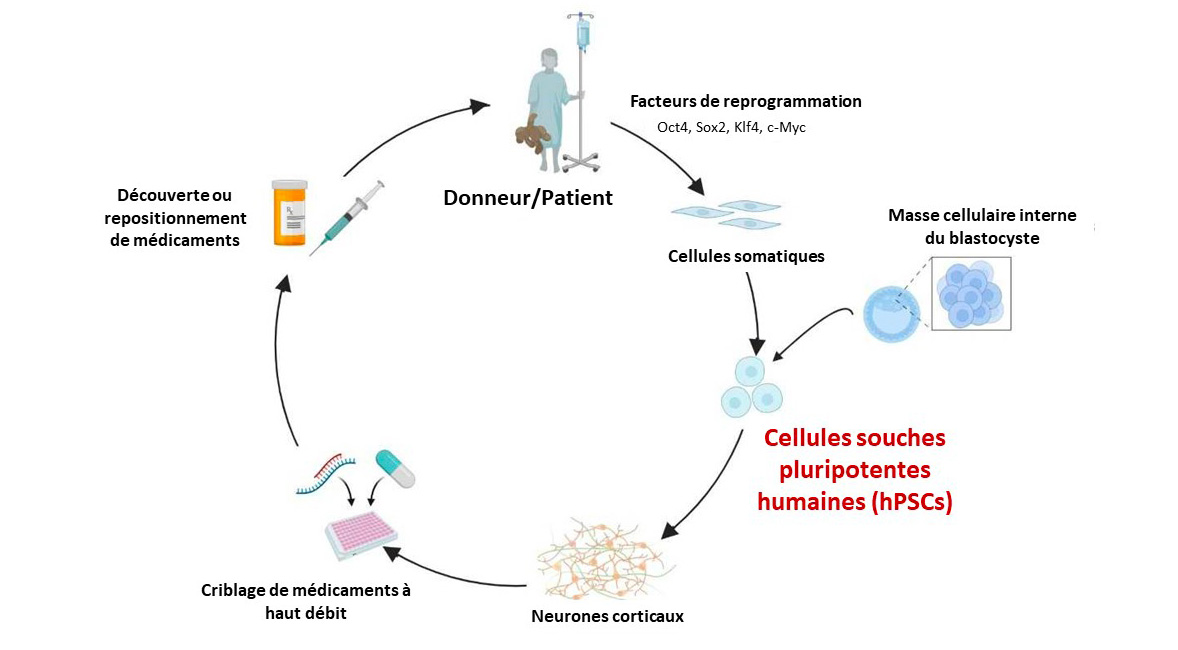
Depuis, elle et son équipe développent des neurones à partir de cellules souches pluripotentes induites (iPSC) de patients, afin de réaliser un criblage à haut débit de molécules ayant potentiellement une activité thérapeutique. C’est le projet qui lui a valu le prix remis par la LFDA.
Grâce à une coopération étroite avec des cliniciens et des associations de patients, le laboratoire a la possibilité de travailler au contact immédiat de patients présentant différentes pathologies. Le prélèvement de cellules de patients est réalisé par simple prise de sang, dont les globules blancs (PBMC) sont ensuite isolés.
En appliquant la méthode du Dr Yamanaka, le laboratoire reprogramme ces cellules en cellules souches pluripotentes (iPSC), puis les différencie en neurones grâce à des milieux successifs contenant des morphogènes. En jouant avec ces facteurs, il est possible d’obtenir des identités neuronales différentes (neurones du cortex préfrontal par exemple), pertinentes pour la pathologie étudiée.
La production de progéniteurs neuronaux nécessite deux mois, puis ils peuvent être congelés pour former d’importantes banques cellulaires pour utilisation future. La différentiation en neurone dure deux semaines, et il faut 4 à 6 semaines pour avoir un réseau neuronal arrivé à maturité fonctionnelle.
Les neurones sont ensuite utilisés par le laboratoire pour faire du criblage à haut débit, évaluant l’activité d’un grand nombre de molécules en même temps contre la maladie. Alexandra Benchoua et son équipe travaillent avec des banques de molécules de repositionnement (molécules étant ou ayant été sur le marché, ou ayant été abandonnées en stade 3 d’essais cliniques) et avec des industries, pour cribler leurs propres chimiothèques et identifier de nouvelles entités, laissant à l'industrie le soin de poursuivre son développement médicamenteux.
Pour évaluer l’efficacité d’une molécule candidate, l’équipe effectue des analyses transcriptomiques, mesure l’excitabilité des neurones et a recours à l’imagerie à haut débit (arborescence des neurones, taille de leurs somas, localisation des protéines d’intérêt...) etc.
Lors de travaux de criblage pour la maladie de Phelan-McDermid, une maladie génétique rare causée par une perte de fonction de SHANK3, le Dr Benchoua a observé que le lithium pouvait induire une augmentation de l’expression de SHANK3 et une relocalisation au niveau des synapses. Cette découverte a permis de lancer un essai clinique, qui est actuellement en phase 3 sous la direction du Pr Richard Delorme.
Une méthode plus éthique et plus pertinente pour la biologie cellulaire humaine
Cette méthode de remplacement de l’animal par des cellules directement dérivées de patients possède plusieurs atouts d’après le Dr Benchoua :
-
Le criblage à haut-débit d’une chimiothèque requiert un nombre très important de neurones, qu’il est facile et rapide d’obtenir en grandes quantités à partir d’iPSC. L’utilisation de cellules animales demanderait une quantité extrêmement importante d’embryons de rongeurs, qu’il faudrait obtenir au même stade de développement et ensuite disséquer pour isoler le tissu neural, ce qui serait extrêmement coûteux en vies animales, en temps, en ressources et financièrement.
-
En travaillant directement avec des cellules de patients, il est possible d’envisager de la thérapie cellulaire, ce qui n’est pas possible avec des cellules animales. Ce domaine étant très réglementé, il nécessite aussi d’éviter au maximum les composés xénogéniques (qui peuvent donner lieu à des contaminations par endotoxines, bactéries, mycoplasmes…) dans les milieux de culture. Cela permet notamment de ne pas utiliser de sérum - et de le remplacer par des milieux synthétiques, composés de petites molécules et de protéines humaines recombinantes, comme l’EGF recombinant (facteur de croissance polypeptidique) - même s’il reste des produits animaux comme l’albumine ou les matrices, produites à partir de cellules de souris.
-
Les iPSC humaines, avec leur génome, épigénome et transcriptome humain, permettent de modéliser des neurones avec des caractéristiques propres à l’Homme (plus fragiles par exemple) ou qui n’existent pas ou peu chez le rongeur (neurones du cortex pré-frontal par exemple).
-
L’utilisation de cellules provenant directement de patients permet de développer une médecine personnalisée qui prend en compte les caractéristiques propres au patient, ce qui est impossible avec des cellules issues de rongeurs congéniques. Le criblage permet alors d’adapter les traitements en fonction de la réponse.
Des modèles de plus en plus représentatifs des tissus cibles
Les cultures développées par le laboratoire pour le criblage haut-débit sont peu complexes (2D), et composées d’un seul type de neurones. Si elles constituent un excellent modèle pour cette application, elles manquent toutefois de la complexité nécessaire pour comprendre l’influence des autres cellules et de l’environnement sur les neurones.
Alexandra Benchoua et son équipe travaillent donc au développement de systèmes plus complexes, pour valider les candidats-médicaments détectés lors du criblage. Ces organoïdes, permettent d’avoir un modèle 3D plus représentatif de l’architecture neuronale. D’autres niveaux de complexification peuvent être envisagés, comme le développement d’assembloïdes pour mettre en contact des neurones de différentes régions du cerveau, ou encore la co-culture sur puces d’organoïdes de différents organes.
Rendre ces modèles plus représentatifs, et donc plus pertinents pour la santé humaine, pourrait en parallèle permettre d’avoir de moins en moins recours aux animaux pour les études pré-cliniques. À cet égard, il serait intéressant d’explorer la possibilité d’une culture cellulaire sans aucun produit d’origine animale.