
3Rs working party

La EMA (European Medicines Agency) a annoncé lors du workshop la création d’un « 3Rs working party » dont le rôle sera de fournir des recommandations et d’aider à l’implémentation des mesures 3R. Cela devrait accélérer la transition vers les NAMs (New Approach Methodologies) dans l’industrie pharmaceutique et le monde de la recherche.
L’EDQM (European Directorate for the Quality of Medicines & HealthCare) et l’EPAA (European Partnership for Alternative Approaches to Animal Testing) ont organisé du 14 au 16 février dernier à Bruxelles, un congrès intitulé « Phasing out the rabbit pyrogen test », pour expliquer et faciliter le remplacement du « test pyrogène sur lapin » par des alternatives in vitro, identifier les efforts qu’il reste à faire en ce sens, encourager la communication entre les différents acteurs du secteur (autorités, industries pharmaceutiques, fournisseurs de tests in vitro...) et ceci, à l’échelle internationale. En plus des conférences, une matinée de discussions pratiques autour de la mise en place des tests in vitro était programmée, et de nombreux représentants hors-UE étaient présents.
Les pyrogènes et leur mode d’action
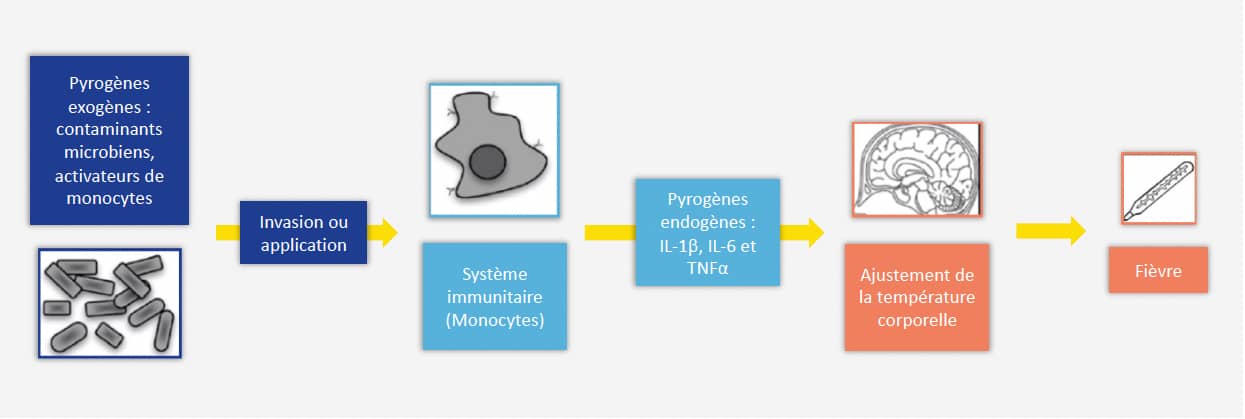
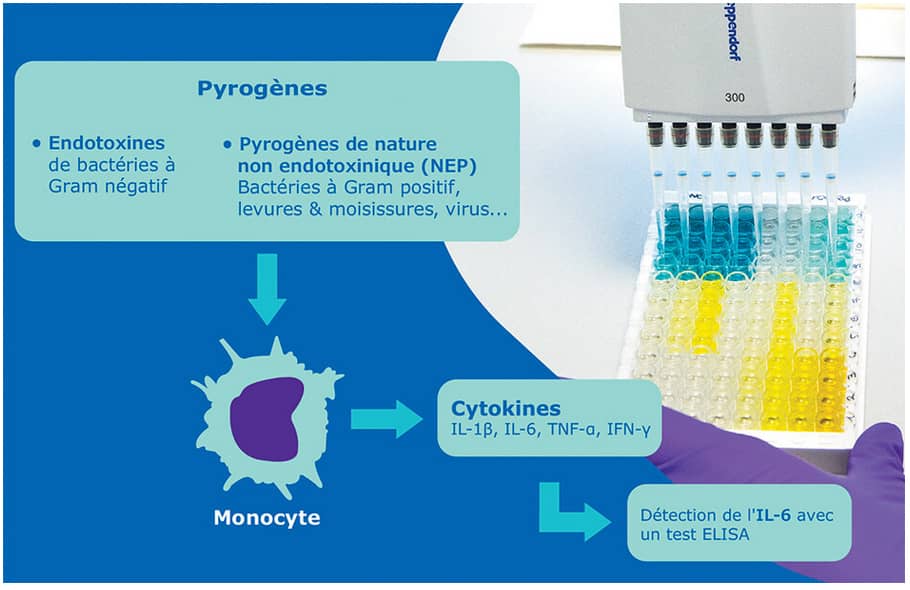
Les produits injectables et les dispositifs médicaux destinés à être implantés dans l’organisme (vaccins, antibiotiques, sang et sous-produits...) peuvent potentiellement être contaminés lors du processus de fabrication, et font donc l’objet d’un contrôle qualité strict pour assurer la sécurité des patients et garantir un résultat similaire et optimal d’un lot à l’autre. Les contaminants potentiels – dits substances « pyrogènes » – peuvent provenir de sources variées (bactéries, virus, levures, moisissures), et déclenchent chez l’hôte une réaction de fièvre via l’activation de son système immunitaire inné, et notamment celle des monocytes. Les pyrogènes sont généralement classifiés en deux groupes : les endotoxines (LPS des bactéries à Gram négatif) et les pyrogènes de nature non-endotoxinique (non-endotoxin pyrogens, NEPs).
Le test pyrogène sur lapins
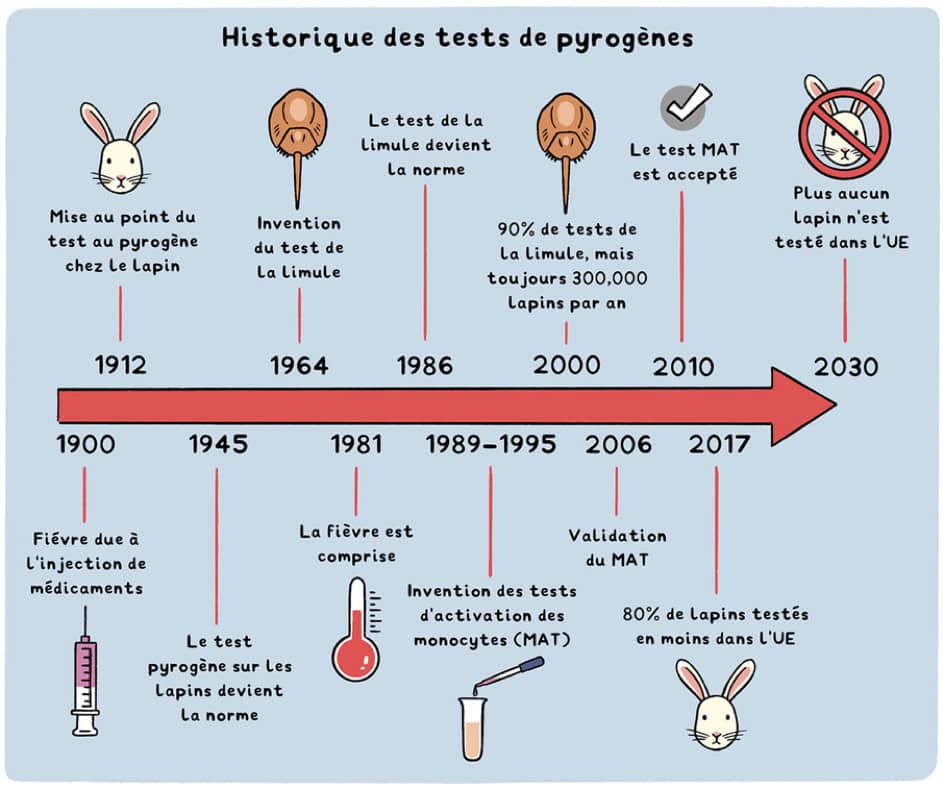
Le test pyrogène sur lapin, ou RPT, développé en 1912 et présent dans la Pharmacopée européenne depuis 1986, consiste à vérifier l’innocuité des produits en testant leur capacité à induire une fièvre chez le lapin. Depuis plusieurs années, cette approche est remise en cause pour de nombreuses raisons : la variabilité des résultats obtenus, le nombre d’animaux utilisés et l’impact sur leur bien-être, la quantité d’endotoxines bactériennes nécessaires pour causer une réaction pyrogène... Les immunologistes alertent également sur la fiabilité de ces tests et les limites de l’utilisation du modèle lapin, dont le système immunitaire est très différent de celui de l’Homme (ref). Il est grand temps de se concentrer sur les bénéfices que peuvent apporter les différentes alternatives au test pyrogène sur lapin.
Quelles alternatives ?
- Détection d’endotoxines grâce au Lysat d'Amébocytes de Limules (LAL) : Le premier test alternatif au RPT, basé sur la coagulation du sang des limules en présence d’endotoxines bactériennes a été développé en 1964 et largement adopté depuis 1987 par les instances réglementaires de l’Union Européenne et du reste du monde. Il s’agit toutefois d’un remplacement relatif, qui n’est pas neutre en termes d’utilisation et de bien-être animal. En effet, ces tests nécessitent encore plus de 500 000 limules par an. Après prélèvements sanguins, elles sont ensuite consommées – au Japon par exemple - ou relâchées, souvent trop affaiblies pour survivre ou se reproduire.
- Depuis 2020, le BET (Bacterial Endotoxin Test), un test in vitro basé sur le principe du LAL, mais utilisant un facteur synthétique recombinant (le factor C « rFC ») dans une réaction biochimique simplifiée, permet de détecter les endotoxines de façon plus simple, fiable et reproductible que le LAL.
- Un autre test in vitro, le test d’activation monocytaire (MAT), développé dans les années 90 et accepté depuis 2010 dans l’Union Européenne, permet de détecter les endotoxines mais également les autres contaminants pyrogènes. Cette méthode utilise des cellules monocytaires humaines qui, au contact des pyrogènes, produisent les cytokines inflammatoires (IL1b, TNFa, IL6...) responsables de la fièvre, qui peuvent être détectées in vitro, par exemple avec un test ELISA. Au-delà de son impact en termes de remplacement d’animaux, le MAT s’avère également plus adapté aux nouvelles générations de vaccins qui ciblent spécifiquement certains aspects du système immunitaire humain - et qui sont donc susceptibles d’induire de la fièvre indépendamment d’une contamination.
Un remplacement qui se fait attendre
Malgré l’existence de ces alternatives, et l’entrée en vigueur en 2013 de la Directive européenne, avec sa volonté explicite de remplacement des méthodes qui ont une alternative sans animaux (in vitro, in silico…), l’abandon du RPT se fait attendre, et les progrès sont lents. Malgré quelques « success stories », comme celle de l’Autriche, qui ne pratique plus de RPT depuis 2019, après avoir été le plus grand utilisateur européen de lapins pour des tests pyrogènes en 2015, ou la diminution totale de 49% d’utilisation de lapins à cette fin dans l’UE depuis 2015, les avancées restent insuffisantes : environ 30 000 lapins sont encore utilisés chaque année en Europe pour des tests pyrogènes. Plus d’un tiers de ces tests ont d’ailleurs lieu en France, qui est aujourd’hui le pays européen qui utilise le plus de lapins pour des tests pyrogènes.
Les raisons invoquées dans les états membres de l’UE sont variables, plusieurs mesures peuvent et doivent donc être prises, à différents niveaux afin d’accélérer et de faciliter cette transition :
|
|
|
|
|
|
L’accessibilité |
Il existe de plus en plus de kits commerciaux standardisés, fiables, adaptés aux différents besoins des utilisateurs de l’industrie pharmaceutique. Ex : ACC, BioMerieux, Immuneed, Lonza (MAT et BET), MAT BioTech, Merck... |
|
Si le BET consiste en une simple technique in chemico, le recours au MAT nécessite de disposer de cellules sanguines humaines, de préférence des PBMC (peripheral blood mononuclear cells) ou du sang - frais ou cryopréservés. Il pourrait être indiqué pour les autorités compétentes de faciliter l’accès à ce matériel humain par des campagnes d’information du grand public et un assouplissement du cadre réglementaire autour des dons de sang et de plasma. |
|
|
Les difficultés techniques |
Certaines organisations et/ou fournisseurs de tests pyrogènes in vitro apportent un soutien pratique dans la prise en main de ces techniques, par la mise en place d’accompagnements personnalisés, de sessions de formations, de troubleshootings... Ex : DCVMN online training, ECA Academy, MAT Research... |
|
Le coût des méthodes alternatives |
Le test in vivo RPT engendre de nombreuses dépenses indirectes qu’il est important de prendre en compte pour effectuer une comparaison avec le coût des tests in vitro : hébergement et soins aux animaux, quantité de matériel requise pour les tests, infrastructures et durée des expériences, nombre de répétitions nécessaires, coût du personnel vs possibilité d’automatisation... |
|
Le coût de ces tests in vitro - encore élevé, car produits en petites quantités - va fortement décroître avec la demande (50 à 80% de diminution du prix sont envisageables pour certains fournisseurs). |
Un véritable effort de volonté semble ainsi nécessaire de la part de l’industrie pharmaceutique pour s’informer et se former aux méthodes alternatives au RPT, et les mettre en œuvre dans leur structure de façon adaptée à leurs besoins.
Il apparaît également indispensable que l’abandon du RPT soit un effort général, mené par les autorités compétentes à l’échelle internationale. En, effet, les différences de protocoles réglementaires entre pays donnent encore lieu à de nombreux tests sur lapins et à des répétitions inutiles. Ainsi, la Pharmacopée européenne, qui recense les tests (in vivo comme in vitro) de sécurité et d’efficacité des « médicaments » est en cours de révision pour que le RPT n’apparaisse plus parmi les méthodes référencées dans sa 12e version qui sortira en 2025. Pour cela, 60 textes seront modifiés.
Dans le même état d’esprit, les différents acteurs présents à la conférence (Chine, Japon, Inde, Brésil, USA...) ont fait part de leur volonté d’abandonner le RPT si les alternatives sont validées. Il apparaît donc plus que jamais nécessaire d’accumuler des preuves scientifiques de l’utilité des tests pyrogènes in vitro pour des applications les plus larges possibles.
